Chúng tôi rất vui mừng chia sẻ kiến thức sâu sắc về từ khóa So3 doc la gi để tối ưu hóa nội dung trang web và tiếp thị trực tuyến. Bài viết cung cấp phương pháp tìm kiếm, phân tích từ khóa và chiến lược hiệu quả. Cảm ơn sự quan tâm và hãy tiếp tục theo dõi để cập nhật kiến thức mới.
Có thể bạn quan tâm
- Hướng dẫn sử dụng ứng dụng Truecaller
- Biểu thức là gì? Cách tính giá trị của biểu thức
- [CẢNH BÁO] Isopropyl Palmitate – thành phần gây mụn số 1 da dầu cần tránh xa
- Break a leg là gì? Cách dùng thành ngữ Break a leg tiếng Anh
- Paid traffic và Free traffic: Cái nào tốt hơn? Paid traffic nghĩa là traffic có trả phí. Thoạt nhìn có vẻ như free traffic là lựa chọn tốt hơn, đơn giản là bởi vì nó miễn phí… Ai ai cũng thích những thứ không cần phải trả tiền mà vẫn có được, tuy nhiên điều đó có nghĩa là ta sẽ phải tìm cách, hoặc tốn nhiều công sức để giành lấy những thứ này, phải không?
Oxit là gì? Công thức của oxit. Phân loại oxit. Tính chất hóa học của oxit. Cách gọi tên các oxit. Đọc SO3 là gì?
Bạn Đang Xem: So3 Đọc Là Gì – Gốc Axit Là Gì
Đang xem: So3 đang đọc là gì
Nhắc tới oxit có nhẽ người nào trong tất cả chúng ta đã và đang một vài lần nghe tới nhưng ít người biết tới vì oxit ko được sử dụng nhiều trong cuộc sống.
Vậy hôm nay qua nội dung bài viết này tất cả chúng ta sẽ cùng nhau tìm hiểu sâu hơn về oxit, để biết nó là gì, có công thức cấu trúc thế nào và có những tính chất gì nhé.
OXIDE LÀ GÌ?
oxit-la-gi?
Ôxít là tên gọi của hợp chất gồm hai yếu tố hóa học, trong đó có một yếu tố là oxi.
Ví dụ: CO2, SO2, P2O5, SO3, Fe2O3, CuO, Cao, N2O5,….
Công thức chung của oxit là MxOy.
Vậy tất cả chúng ta cùng tìm hiểu nhé SO3 đọc gì? Minh họa cho nghiên cứu tiếp theo.
Đọc SO3 là gì?
SO3 là việc liên kết của hai yếu tố hóa học gồm Lưu huỳnh (S) hóa trị II, IV, VI, … và yếu tố Oxy (O) hóa trị II. SO3 sẽ tiến hành đọc là Sulfur trioxide. Tương tự như cách đọc tên SO3, tất cả chúng ta cũng sẽ sở hữu được SO2 (lưu huỳnh đioxit).
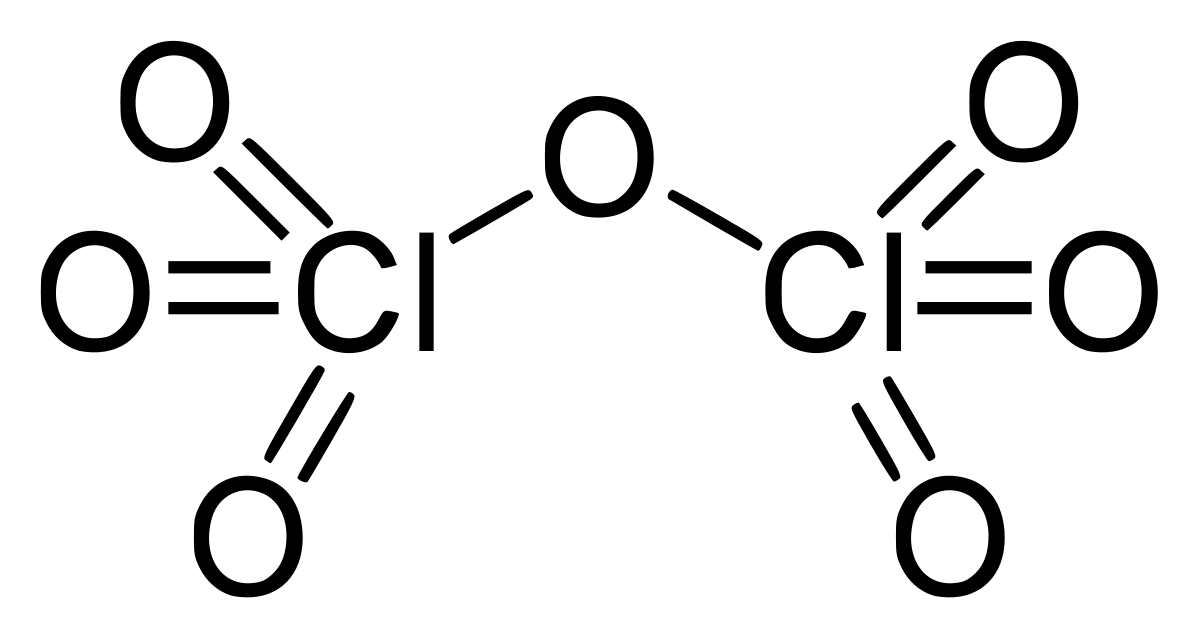
SO3-doc-la-gi
Cách đọc SO3 hay SO3 gọi là gì sẽ là nền tảng để bạn biết thêm về công thức oxit và các dạng oxit khác.
CÔNG THỨC XƯƠNG KHỚP
Dichloro-heptaoxide-Cl2O7
Công thức chung của oxit là MxOy.
Trong số đó: gồm kí hiệu hoá học là O (Oxi) có hoá trị II kèm theo chỉ số y và kí hiệu hoá học của yếu tố M có hoá trị n.
Theo quy tắc hoá trị, ta có: II xy = nx x.
PHÂN LOẠI XƯƠNG
Oxit được phân thành hai loại chính: oxit axit và oxit bazơ.
Oxit axit
Oxit axit thường là oxit của khá nhiều phi kim loại, lúc cho oxit phản ứng với nước sẽ thu được axit tương ứng.
Ví dụ:
CO2: axit tương ứng là axit cacbonic; H2CO3P2O5: axit tương ứng là axit photphoric H3PO4
Một số tính chất của Oxit axit như sau:
Độ hòa tan: Hồ hết các oxit có tính axit lúc tan trong nước đều cho dung dịch có tính axit, trừ SiO2:
Na2O + H2SO4 → Na2SO4 + H2O
FeO + HCl → FeCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
Phản ứng với oxit bazơ tan: Oxit axit phản ứng với oxit bazơ tan tạo thành muối:
SO3 + CaO -> CaSO4
P2O5 + 3Na2O -> 2Na3PO4
Phản ứng với bazơ tan: Tùy thuộc vào tỉ lệ số mol giữa oxit axit và bazơ, phản ứng sẽ cho nước + muối trung hòa, muối axit hoặc hỗn hợp 2 muối:
Gốc axit tương ứng có hóa trị II:
– So với kim loại trong bazơ có hóa trị I:
Tỉ lệ mol B: OA là một trong:
NaOH + SO2 -> NaHSO3 (Phản ứng tạo muối axit)
Tỉ lệ mol B: OA là 2:
2KOH + SO3 -> K2SO3 + H2O (Phản ứng tạo muối trung hòa)
– So với kim loại trong bazơ có hóa trị II:
Tỉ lệ mol của OA: B là một trong:
CO2 + Ca (OH) 2 -> CaCO3 (Phản ứng tạo muối trung hòa)
Tỉ lệ mol của OA: B là 2:
SiO2 + Ba (OH) 2 -> BaSiO3 (Phản ứng tạo muối axit)
So với axit có gốc axit hóa trị ba:
So với kim loại có hóa trị I:
Tỉ lệ mol B: OA là 6:
P2O5 + 6NaOH -> 2Na2HPO4 + H2O
Tỉ lệ mol B: OA là 4:
Xem Thêm : Thot là gì? Ý nghĩa của Thot và nguồn gốc ra đời của Thot
P2O5 + 4NaOH -> 2NaH2PO4 + H2O
Tỉ lệ mol B: OA là 2:
P2O5 + 2NaOH + H2O -> 2NaH2PO4
Oxit bazơ
Oxit bazơ thường là oxit của kim loại và tương ứng với một bazơ.
Ví dụ:
CaO: bazơ tương ứng là canxi hiđroxit Ca (OH) 2CuO: bazơ tương ứng là đồng hiđroxit Cu (OH) 2Fe2O3: bazơ tương ứng là Fe (OH) 3Na2O: bazơ tương ứng là NaOH
Một số tính chất của oxit bazơ như sau
Tác dụng với nước: Chỉ có oxit bazơ của kim loại kiềm và kiềm thổ mới phản ứng được với nước. Các oxit bazơ phản ứng với nước và do đó cũng tan trong nước là: Na2O, K2O, CaO, BaO, Li2O, Rb2O, Cs2O, SrO.
Công thức: R2On + nH2O -> 2R (OH) n (n là hóa trị của kim loại R).
Xem thêm: Hướng dẫn Học Tiếng Việt lớp 3, Soạn bài Vnen Tiếng Việt lớp 3
R (OH) n tan trong nước, dung dịch tạo thành thường được gọi là dung dịch bazơ hay dung dịch kiềm (dung dịch bazơ tan). Các dung dịch bazơ này thường làm giấy quỳ chuyển sang màu xanh lam và phenolphtalein từ ko màu sang màu hồng.
Phản ứng với axit: Hồ hết các oxit bazơ đều phản ứng với axit (Thường là HCl hoặc H2SO4) để tạo thành muối và nước.
Công thức: Oxit bazơ + Axit -> Muối + H2O
Phản ứng với oxit axit: Một số oxit bazơ phản ứng với oxit axit tạo thành muối. Thông thường nó là các oxit phản ứng với nước (tan trong nước).
Công thức: Oxit bazơ + Oxit axit —-> Muối
Ngoài ra, còn tồn tại oxit lưỡng tính và oxit trung tính
Oxit lưỡng tính: là oxit có thể phản ứng với axit hoặc bazơ để tạo thành muối và nước. Ví dụ: Al2O3, ZnOxit trung tính: là oxit ko phản ứng với nước tạo ra bazơ hoặc axit, nhưng oxit này ko phản ứng với bazơ hoặc axit tạo thành muối. Ví dụ: Cacbon monoxit, Nitơ monoxit, ..
TÍNH CHẤT HÓA HỌC CỦA OXI HÓA
Tính chất của oxit axit: Gồm 3 chỗ nghỉ
Tác dụng với nước
Lúc oxit axit phản ứng với nước sẽ tạo thành axit tương ứng
Cách viết: oxit axit + H2O-> axit
Ví dụ: SO2 + H2O H2SO3
CO2 + H2O H2CO3
Phản ứng với bazơ
Chỉ có bazơ của kim loại kiềm và kiềm thổ mới phản ứng được với oxit axit. Cụ thể là 4 bazơ sau: NaOH, Ca (OH) 2, KOH, Ba (OH) 2.
Cách viết: oxit bazơ + bazơ -> muối + H2O
Ví dụ: CO2 + KOH -> K2CO3 + H2O
SO2 + Ba (OH) 2 -> BaSO3 + H2O
Phản ứng với oxit bazơ
Một số oxit bazơ phản ứng với oxit axit tạo thành muối
Thông thường đó là các oxit phản ứng với nước (Na2O, CaO, K2O, BaO).
Cách viết: oxit bazơ + oxit axit -> muối
———— (Na2O, CaO, K2O, BaO) —— (CO2, SO2)
Tính chất hóa học của oxit bazơ: Gồm 3 chỗ nghỉ
Tác dụng với nước
Chỉ có oxit bazơ của kim loại kiềm và kiềm thổ mới phản ứng được với nước. Cụ thể là 4 oxit sau: Na2O, CaO, K2O, BaO.
Cách viết: R2On + nH2O -> 2R (OH) n (n là hóa trị của kim loại R)
R (OH) n tan trong nước, dd thu được gọi là dd bazơ hay dd kiềm
Một số oxit bazơ phản ứng với nước tạo thành dd bazơ (còn gọi là dd kiềm).
Ví dụ: BaO + H2O -> Ba (OH) 2
Na2O + H2O -> NaOH
Phản ứng với axit
Hồ hết các oxit bazơ đều phản ứng với axit tạo thành muối và nước
Cách viết: oxit bazơ + Axit -> muối + H2O
Ví dụ: CaO + HCl -> CaCl2 + H2O
—- Canxi oxit — axit clohydric — muối canxi clorua
Fe2O3 + 3H2SO4 -> Fe2 (SO4) 3 + 3H2O
Xem Thêm : Blog
Sắt (III) oxit ——— axit sunfuric ————— sắt sunfat
Phản ứng với oxit axit
Chỉ một số oxit bazơ phản ứng với oxit axit tạo thành muối
Thông thường đó là các oxit phản ứng với nước (Na2O, CaO, K2O, BaO).
Cách viết: oxit bazơ + oxit axit -> muối
———— (Na2O, CaO, K2O, BaO) —— (CO2, SO2)
CÁCH ĐẶT TÊN OXY
So với kim loại, phi kim chỉ có một hóa trị
Cách gọi tên oxit như sau: tên oxit = tên yếu tố + oxit
Ví dụ:
K2O: Ôxít kali
KHÔNG: Ôxít nitơ
CaO: Canxi oxit
Al2O3: Nhôm oxit
Na2O: Natri oxit
So với kim loại có nhiều hóa trị
Cách đặt tên như sau: tên oxit = tên kim loại (hóa trị) + oxit
Ví dụ:
FeO: sắt (II) oxit
Fe2O3: sắt (III) oxit
CuO: đồng (II) oxit
So với các phi kim loại có nhiều hóa trị
Cách đặt tên như sau:
Tên oxit = (tiền tố chỉ số nguyên tử phi kim) tên phi kim + (tiền tố chỉ số nguyên tử oxit) oxit
Cụ thể: tiền tố đơn âm là -1; tiền tố gửi đi là -2; tiền tố tetra là -4; tiền tố penta là -5, tiền tố thập lục phân là -6; tiền tố hepta là -7; tiền tố quãng tám là -8.
Ví dụ:
CO: oxit cacbon
SO2: lưu huỳnh đioxit
CO2: carbon dioxide
SO3: lưu huỳnh trioxit
P2O5: điphotphat pentaoxit
CÁCH GIẢI QUYẾT BÀI TẬP AXIT AXIT BẰNG CƠ SỞ
Dạng 1: Oxit có tính axit (CO2, SO2 …) phản ứng với dung dịch kiềm (KOH, NaOH …)
Phương trình:
CO2 + NaOH → NaHCO3 (a) CO2 + 2NaOH → Na2CO3 + H2O (b)
Các bước giải pháp như sau:
Bước 1: Xét tỉ lệ số mol của bazơ và oxit axit, giả sử T
Nếu T ≤ 1: Thành phầm thu được là muối axit thì chỉ xẩy ra phản ứng (a). Nếu 1 Nếu T ≥ 2: Thành phầm thu được là muối trung hòa, chỉ có phản ứng (b).
Bước 2: Viết phương trình phản ứng và tính toán theo phương trình đó (nếu cả hai phản ứng xẩy ra thì hãy đặt ẩn và giải theo hệ phương trình)
Bước 3: Thực hiện phép tính theo yêu cầu của bài toán.
Dạng 2: Oxit có tính axit (CO2, SO2…) phản ứng với dung dịch kiềm thổ (Ca (OH) 2, Ba (OH) 2…)
Phương trình:
CO2 + Ca (OH) 2 → CaCO3 + H2O (a) 2CO2 + Ca (OH) 2 → Ca (HCO3) 2 (b)
Các bước giải pháp như sau:
Bước 1: Xem xét tỉ lệ
Nếu T ≤ 1: Thành phầm thu được là muối trung hòa (xẩy ra phản ứng (a)). Nếu 1 Nếu T ≥ 2: Thành phầm thu được là một muối axit (xẩy ra phản ứng (b)).
Nguồn: Trường trung học phổ thông Trần Hưng Đạo
Bạn thấy nội dung bài viết So3 Đọc Là Gì – Gốc Axit Là Gì có khắc phục đươc vấn đề bạn tìm hiểu ko?, nếu ko hãy comment góp ý thêm về So3 Đọc Là Gì – Gốc Axit Là Gì phía bên dưới để thpttranhungdao.edu.vn có thể thay đổi & cải thiện nội dung tốt hơn cho độc giả nhé! Cảm ơn bạn đã ghé thăm Website Trường trung học phổ thông Trần Hưng Đạo
Phân mục: Hỏi đáp
Nguồn: thpttranhungdao.edu.vn


