Chúng tôi rất vui mừng được chia sẻ kiến thức sâu sắc về từ khóa Khi nito la gi và hy vọng rằng nó sẽ hữu ích cho bạn đọc. Bài viết tập trung trình bày ý nghĩa, vai trò và ứng dụng của từ khóa này trong việc tối ưu hóa nội dung trang web và chiến dịch tiếp thị trực tuyến. Chúng tôi cung cấp các phương pháp tìm kiếm, phân tích và lựa chọn từ khóa phù hợp, cùng với các chiến lược và công cụ hữu ích. Hy vọng rằng thông tin mà chúng tôi chia sẻ sẽ giúp bạn xây dựng chiến lược thành công và thu hút lưu lượng người dùng. Xin chân thành cảm ơn sự quan tâm và hãy tiếp tục theo dõi blog của chúng tôi để cập nhật những kiến thức mới nhất.
Bạn có biết rằng trong không khí mà tất cả chúng ta hít thở, nitơ chiếm nhiều nhất. Nó sở hữu đến 78%, sót lại là 21% oxi và 1% các loại khí khác. Mặc dù con người không dùng khí nitơ để hít thở nhưng chúng rất có ích trong nhiều ngành công nghiệp. Vậy nitơ là gì? Nó có tính chất gì đặc biệt quan trọng và có những ứng dụng nào? Hãy cùng chúng tôi tìm hiểu thông qua nội dung bài viết ở đây nhé!
Bạn Đang Xem: Khí nitơ là gì? Tính chất và ứng dụng của nitơ trong cuộc sống?
1. Khái niệm khí nitơ là gì?
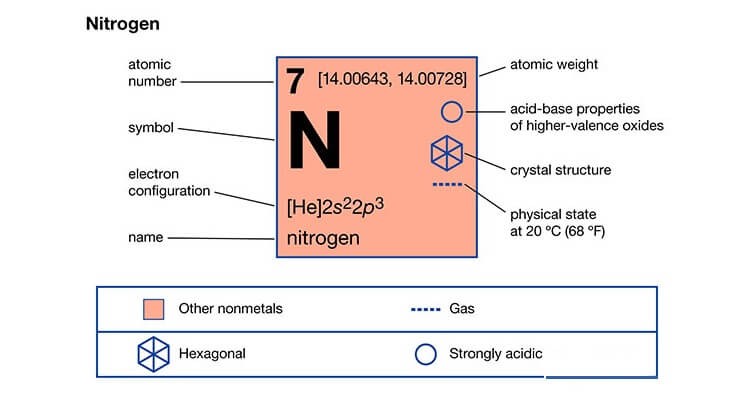
Nitơ (N) là nhân tố hóa học thuộc nhóm phi kim trong bảng tuần hoàn các nhân tố. Nito có mặt trong tất cả những thân thể sống, nó cấu trúc nên nhiều hợp chất quan trọng như: axit amin, amoniac, axit nitric,… Thân thể người chứa khoảng tầm 3% nitơ theo trọng lượng.
Khí nitơ có công thức hoá học là N2. Nó có 5 điện tử trên lớp ngoài cùng nên có thể nhận nhiều electron với nhiều hoá trị khác nhau như II, III và IV.
Nitơ thường có dạng lỏng hoặc khí (mặc dù nito có thể đạt được thể rắn khi ngừng hoạt động ở -210 độ C). Trong không khí, nó tồn tại dưới dạng phân tử N2, không phản ứng với những loại khí khác nên gọi là khí trơ. Nó hóa lỏng ở nhiệt độ rất thấp – 196 độ C, trong ĐK áp suất khí quyển.
Với cấu trúc hoá học của nitơ, nguyên tử nitơ cần nhiều năng lượng hơn để phá vỡ để phản ứng với những chất khác. So với khí oxy, khí nitơ ít phản ứng hơn và không bắt lửa và thực hiện phản ứng đốt cháy. Này cũng đó là lý do để ngăn chặn các quá trình oxi hoá chậm và nhanh nên giúp con người an toàn trong ĐK nhiệt độ và áp suất thường.

2. Cấu trúc phân tử của nitơ
Phân tử nitơ gồm 2 nguyên tử, giữa chúng hình thành một liên kết 3 do nó có 5 electron ở lớp vỏ ngoài nên thể hiện hóa trị 3 trong hồ hết các hợp chất.
Trong các hợp chất, nito thể hiện nhiều mức oxi hóa khác nhau. Trong số đó, mức oxi hoá tốt nhất có thể là +5, còn các mức là -3 và +3 thì ít gặp hơn. Riêng N còn tồn tại thêm các mức oxi hoá +1, +2 và +4.
3. Tính chất của khí nitơ
Khí nito có những đặc trưng ở đây:
3.1. Tính chất vật lý
Khí Nitơ là chất khí không màu, không mùi, không vị. Nó có nhẹ hơn không khí. Nitơ chiếm 4/5 trong không khí nhưng không có khả năng duy trì sự cháy và sự sống.
Nito ít tan trong nước. Những thông số đặc trưng gồm:
- Nhiệt độ hoá lỏng ở -196 độ C: Khí được ngưng tụ thành chất lỏng không màu, nhẹ hơn nước.
- Nhiệt độ hoá rắn cũng rất thấp ở -210 độ C
3.2. Tính chất hoá học
Nitơ là một hoạt chất ít tham gia các phản ứng hóa học, chỉ trong những ĐK nhất định do phân tử chứa liên kết ba rất vững bền nên ở ĐK thường. Nito vừa là chất khử vừa là chất oxi hoá.
Các mức oxi hoá mà nitơ có thể có là: -3, 0, +1, +2, +3, +4, +5. Nó có số oxi hóa 0 nên vừa thể hiện tính oxi hóa và tính khử.
– Tính oxi hoá
- Nitơ tác dụng với kim loại: Nitơ thể hiện tính oxi hóa khi tác dụng với nhân tố có độ âm điện nhỏ hơn.
Trong ĐK nhiệt độ thường, nitơ chỉ tác dụng với liti tạo liti nitrua: 6 Li + N2 → 2 Li3N
Xem Thêm : Da simili là gì, ưu nhược điểm và những ứng dụng phổ biến
Trong ĐK nhiệt độ cao, nitơ tác dụng với nhiều kim loại như 3 Mg + N2 → Mg3N2
Tuy nhiên, các nitrua dễ bị phân hủy tạo NH3
- Nitơ tác dụng với H2: Ở nhiệt độ cao, áp suất cao và có chất xúc tác. Nitơ phản ứng với hidro tạo ra amoniac.
– Tính khử (N2 + O2): Nitơ thể hiện tính khử khi tác dụng với nhân tố có độ âm điện to ra hơn như oxy.
Phản ứng của nitơ với oxi xẩy ra ở nhiệt độ 3000 độ C hoặc trong lò hồ quang quẻ điện: 2N + O2 → 2NO
Sau đó, nitơ monoxit tác dụng với oxi không khí tạo nitơ dioxit màu nâu đỏ: NO+1/2O2→NO2
Các oxit khác của nitơ là N2O, N2O3, N2O5 không điều chế trực tiếp được từ phản ứng giữa oxi và nitơ.
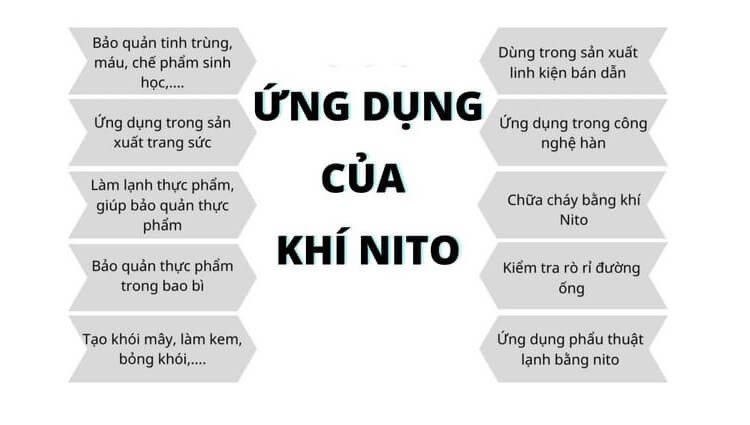
4. Ứng dụng của nitơ trong cuộc sống
Nitơ được sử dụng rộng rãi, chủ yếu do tính chất không phản ứng khi xúc tiếp với những loại khí khác. Vì vậy, nó được sử dụng làm một loại khí phủ. Lớp phủ nitơ được sử dụng để bảo vệ các chất rắn và chất lỏng dễ cháy hoặc nổ khi xúc tiếp với không khí.
- Trong công nghiệp, phần lớn lượng nitơ được dùng làm tổng hợp khí amoniac, tiếp theo là sinh sản ra axit nitric, phân đạm,… Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử,… sử dụng nitơ làm môi trường thiên nhiên trơ.
- Trong y tế, dược phẩm, Nitơ lỏng được dùng làm dữ gìn và bảo vệ máu và các vật mẫu sinh vật học khác. Ngoài ra, nó còn là một môi trường thiên nhiên để làm lạnh sâu, nhanh các sản phẩm huyết thanh, vi trùng… Nitơ lỏng được sử dụng trong phẫu thuật lạnh để phá hủy mô bệnh.
- Ngành công nghiệp thực phẩm và thức uống, nitơ được sử dụng để thay thế khí oxi trong việc dữ gìn và bảo vệ nông sản, đồ uống tốt hơn. Do độ lạnh cực mạnh trong nitơ lỏng được chấp nhận làm ướp đông lạnh thực phẩm rất nhanh.
- Ngành dầu khí, các xí nghiệp sản xuất lọc dầu, xí nghiệp sản xuất hóa dầu và tàu chở dầu biển sử dụng nitơ để thanh lọc thiết bị, bể chứa và đường ống chứa hơi và khí nguy hiểm. Ngoài ra, nó còn làm mát các lò phản ứng chứa đầy chất xúc tác trong quá trình bảo trì.
Trên đây là những tri thức về nito cũng như khí nito trong không khí. Từ đó giúp đỡ bạn làm rõ hơn về một loại khí phổ quát xung quanh tất cả chúng ta.


