Hôm nay Kiến Guru xin gửi tới những bạn lý thuyết phản ứng oxi hóa khử lớp 10 và giải các bài tập trang 83 sách giáo khoa hóa lớp 10. Nội dung bài viết tổng hợp toàn bộ lý thuyết liên quan đến oxi hóa-khử và hướng dẫn giải bài tập trang 83 sách giáo khoa một cách cụ thể chi tiết. Mong rằng đây sẽ là tài liệu giúp các bạn củng cố lại tri thức của mình. Mời các bạn cùng khám phá nội dung bài viết:
I. Phản ứng oxi hóa – khử lớp 10
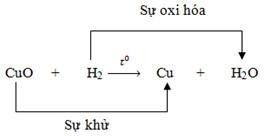
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất trong phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số yếu tố.
Đang xem: Tính khử là gì
– Chất khử (chất bị oxh) là chất nhường electron
– Quá trình oxh (sự oxh) là quá trình nhường electron.
– Quá trình khử (sự khử) là quá trình thu electron.
Ví dụ:
Quá trình thay đổi số oxi hóa:
Fe0→ Fe2++ 2e
– Nguyên tử sắt là chất khử. Sự làm tăng số oxi hóa của sắt được gọi là sự việc oxi hóa nguyên tử sắt.
– Nguyên tử sắt nhường electron, là chất khử. Sự nhường electron của nguyên tử sắt được gọi là sự việc oxi hóa nguyên tử sắt.
Cu2+ + 2e → Cu
– Số oxi hóa của đồng giảm từ +2 xuống 0. Ion đồng là chất oxi hóa. Sự làm giảm số oxi hóa của ion đồng được gọi là sự việc khử ion đồng.
– Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự việc khử ion đồng.
⇒ Phản ứng của sắt với dung dịch đồng sunfat cũng là phản ứng oxi hóa – khử vì tồn tại song song sự oxi hóa và sự khử.
II. Lập phương trình hóa học của phản ứng oxi hóa khử lớp 10
Bước 1:Xác định số oxi hóa của nhiều yếu tố để tìm chất oxi hoá và chất khử.
Bước 2:Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
Bước 3:Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
Bước 4:Đặt hệ số của nhiều chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của nhiều yếu tố và cân bằng điện tích hai vế để hoàn thành PTHH.
III. Ý nghĩa của phản ứng oxi hóa khử lớp 10
– Phản ứng oxi hóa – khử là một trong những quá trình quan trọng nhất của tự nhiên:
Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic phóng thích oxi, sự trao đổi chất và hàng loạt quá trình sinh vật học khác đều phải sở hữu cơ sở là các phản ứng oxi hóa – khử.
– Ngoài ra: Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xẩy ra trong pin và trong ăcquy đều gồm có sự oxi hóa và sự khử.
Hàng loạt quá trình sinh sản như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học, … đều không thực hiện được nếu thiếu các phản ứng oxi hóa – khử.
IV. Hướng dẫn giải bài tập phản ứng oxi hóa khử lớp 10 trang 83.
Bài 1:Cho phản ứng sau:
A. 2HgO 2Hg + O2.
B. CaCO3 CaO + CO2.
C. 2Al(OH)3Al2O3 + 3H2O.
D. 2NaHCO3Na2CO3 + CO2 + H2O.
phản ứng oxi hóa – khử là đáp án nào
Lời giải:
Những phản ứng theo đề bài cho, phản ứng oxi hóa – khử là : A.
2HgO 2Hg + O2.
Hg2++ 2e → Hg0
2O2-→ O2+ 4e
Còn các phản ứng khác không phải là phản ứng oxi hóa khử
Bài 2:Cho những phản ứng sau:
A. 4NH3 + 5O2→ 4NO + 6H2O.
B. 2NH3 + 3Cl2→ N2 + 6HCl.
C. 2NH3 + 3CuO → 3Cu + N2+ 3H2O.
D. 2NH3 + H2O2+ MnSO4 → MnO2 + (NH4)2SO4.
Xem thêm: 4 Quy Tắc Học Tiếng Anh Quan Trọng Nhất Bạn Phải Biết!, 4 Quy Tắc Phát Âm Tiếng Anh Nhất Định Phải Nhớ
Ở phản ứng nào NH3không đóng vai trò chất khử?
Lời giải:
Phản ứng NH3không đóng vai trò chất khử.
D. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4.
Do N không thay đổi số oxi hóa trước và sau phản ứng.
Bài 3:Trong số các phản ứng sau:
A. HNO3 + NaOH → NaNO3 + H2O.
B. N2O5 + H2O → 2HNO3.
C. 2HNO3 + 3H2S → 3S + 2NO + 4H2O.
D. 2Fe(OH)3 → Fe2O3+ 3H2O.
Phản ứng nào là phản ứng oxi hóa – khử.
Lời giải:
Trong các phản ứng trên chỉ có phản ứng C là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của nhiều yếu tố.
Bài 4:Trong phản ứng 3NO2 + H2O → 2HNO3 + NO. NO2 đóng vai trò gì?
A. Chỉ là chất oxi hóa.
B. Chỉ là chất khử.
C. Là chất oxi hóa, nhưng song song cũng là chất khử.
D. Không là chất oxi hóa, không là chất khử.
Chọn đáp án đúng.
Lời giải:
NO2 đóng vai trò vừa là chất oxi hóa vừa là chất khử: C đúng
Bài 5:Phân biệt chất oxi hóa và sự oxi hóa, chất khử và sự khử. Lấy ví dụ để minh họa.
Lời giải:
Chất oxi hóa là chất nhận electron.
Sự oxi hóa một chất là làm cho chất đó nhường electron.
Chất khử là chất nhường electron.
Sự khử một chất là sự việc làm cho chất đó thu electron.
Ví dụ:
– Nguyên tử Fe nhường electron, là chất khử. Sự nhường electron của Fe được gọi là sự việc oxi hóa nguyên tử sắt.
– Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự việc khử ion đồng.
Bài 6: Thế nào là phản ứng oxi hóa – khử? Lấy ba ví dụ.
Lời giải:
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất phản ứng.
Tỉ dụ:
Bài 7:Lập phương trình phản ứng oxi hóa – khử sau đây theo phương pháp thăng bằng electron:
a) Cho MnO2 tác dụng với dung dịch axit HCl đặc, thu được MnCl2, Cl2 và H2b) Cho Cu tác dụng với dung dịch axit HNO3 đặc, nóng thu được Cu(NO3)2, NO2, H2c) Cho Mg tác dụng với dung dịch axit H2SO4 đặc, nóng thu được MgSO4, S và H2
Lời giải:
Các phương trình hóa học là.
Xem thêm: Người Mới Học Tiếng Anh Bắt Đầu Từ Đâu Và Như Thế Nào? Học Tiếng Anh Bắt Đầu Từ Đâu
Bài 8:Cần bao nhiêu gam đồng để khử hoàn toàn lượn ion bạc có trong 85ml dung dịch AgNO30,15M?
Lời giải:
Phương trình hóa học của phản ứng:
Cu + 2AgNO3 → Cu(NO3)2+ 2Ag
Theo pt:
mCutham gia phản ứng: 0,006375 × 64 = 0,408 g.
Lý thuyết phản ứng oxi hóa khử lớp 10 và giải các bài tập trang 83 sách giáo khoa hóa lớp 10 do kiến soạn nhằm giúp cho những bạn có thêm tài liệu và giải các bài tâp trang 83 hiệu quả nhất. Tri thức về phản ứng oxi hóa-khử rất là hay và thú vị. Kiến mong rằng các bạn hãy xem nó một cách nghiêm túc để cho những bạn đã đoạt kinh nghiệm và tri thức cần nắm nhé. Chúc các bạn thành công
