Ete là một hợp chất hóa học được ứng dụng trong nhiều ngành khác nhau như y khoa, công nghiệp… Vậy ete có cấu trúc ra sao? Tính chất lý hóa học? Ứng dụng của nó? Để tìm hiểu vấn đề này, tất cả chúng ta hãy cùng nhau tìm hiểu thông qua nội dung bài viết sau này nhé!
1. Ete là gì?
Ete là một loại hợp chất hữu cơ chứa một nhóm ete, trong đó nguyên tử oxy được liên kết với hai nhóm alkyl hoặc aryl. Từ Ete có nguồn gốc từ tiếng Latin ‘aether’ có tức thị ‘đốt cháy’. Ở nhiệt độ phòng và dưới áp suất cao, ete thường rất dễ cháy.
2. Cấu trúc của ete ra sao?
Công thức chung của ete là ROR, RO-R’, RO-Ar hoặc Ar-O-Ar, trong đó R, R’ là nhóm alkyl và Ar là nhóm aryl.
Trong tương lai là một vài ví dụ về ete:
- CH3-O-CH3 (Dimetyl ete)
- (CH3)2CH-O-CH(CH3)2 (Diisopropyl ete)
- Các ete vòng như: C6H5-O-C6H5 (Diphenyl ete)
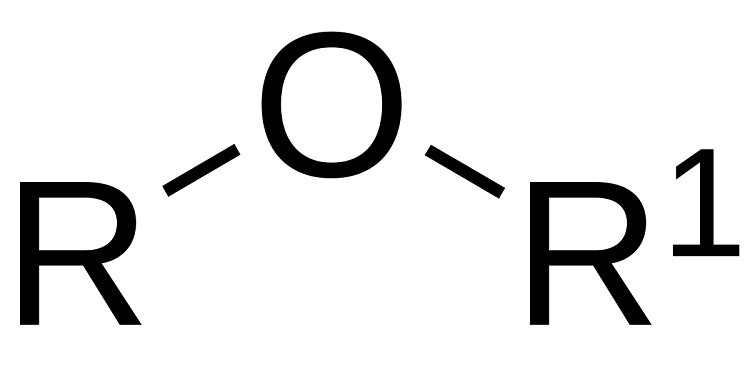
Cấu trúc của ete
3. Tính chất lý hóa học của ete
Các tính chất cơ bản của ete như sau:
3.1. Tính chất vật lý
– Trạng thái tồn tại: Ở nhiệt độ phòng, ete là chất lỏng không màu có mùi dễ chịu. So với rượu, ete thường nhẹ hơn, ít tan trong nước. Riêng, dimetyl ete và etyl metyl ete là chất khí ở nhiệt độ phòng.
– Mômen lưỡng cực: Góc liên kết COC không phải là 180°, mômen lưỡng cực của hai liên kết CO không triệt tiêu lẫn nhau và do đó ete có momen lưỡng cực nhỏ.
– Tính phân cực: Ete ít phân cực hơn este, ancol hoặc amin vì nguyên tử oxy không thể tham gia liên kết hydro do sự hiện hữu của rất nhiều nhóm alkyl kềnh càng ở cả hai phía của nguyên tử oxi. Tuy nhiên ete phân cực hơn anken.
– Điểm sôi:
+ Điểm sôi của rất nhiều phân tử ete tương đương với điểm sôi của ankan nhưng lại rất thấp so với alcol có khối lượng phân tử tương đương.
+ Điều này là vì sự hiện hữu của liên kết hidro trong alcol.
– Độ tan:
+ Độ tan của ete/nước giống với độ tan của rất nhiều ancol có phân tử khối tương đương. Các phân tử ete hòa tan trong nước. Do ete có thể tạo liên kết hidro với cùng 1 phân tử nước.
+ Độ hòa tan giảm khi tăng nguyên tử carbon. Điều này là vì sự tăng lên tương đối lượng hydrocacbon trong phân tử làm giảm xu hướng hình thành liên kết H.
3.2. Tính chất hóa học
Trong tất cả những nhóm chức, ete là nhóm ít phản ứng nhất. Liên kết ete khá bền khi đối chiếu với chất oxi hóa, chất khử và bazơ. Tuy nhiên, nó có thể tham gia quá trình phân tích bằng phản ứng với axit.
Các phản ứng hóa học nổi trội của ete gồm:
– Phản ứng phân tích:
Hồ hết, các ete có thể bị phân cắt bởi HBr để tạo ra alkyl bromua hoặc HI để tạo ra alkyl iodua.
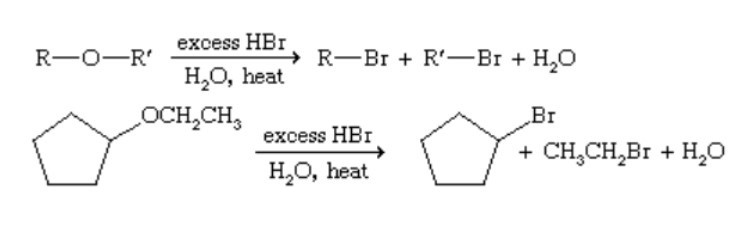
– Phản ứng cháy (tự oxy hóa):
Khi ete xúc tiếp với không khí với sự hiện hữu của tia UV hoặc ánh sáng mặt trời, liên kết peroxide sẽ tiến hành hình thành.
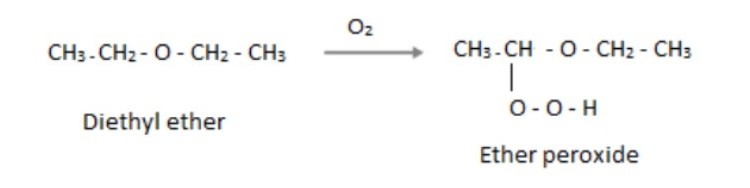
Phản ứng oxi hóa của ete
– Phản ứng halogen hóa:
Trong vòng benzen, phenyl alkyl ete thực hiện phản ứnghalogen hóa thông thường.
Ví dụ: anisole + brom trong axit ethanoic ngay cả những lúc không có chất xúc tác sắt (III) bromua. Điều này xẩy ra do sự kích hoạt vòng benzen bởi nhóm methoxy. Đồng phân para thu được với hiệu suất 90%.
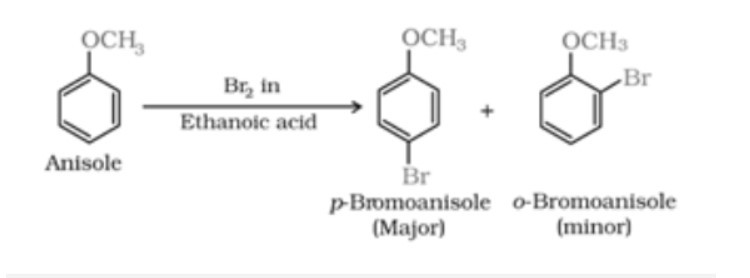
– Phản ứng nitrat hóa:
Bất kì khi nào anisole được nitrat hóa bằng hỗn hợp axit nitric (HNO3) và axit sulfuric (H2SO4) đậm đặc, nó sẽ tạo ra hỗn hợp ortho-Nitroanisole và para-Nitroanisole (chính).
4. Điều chế ete ra sao?
Có một số mẹo điều chế ete như sau:
– Khử nước của ancol:
Ancol tham gia phản ứng khử nước với sự có mặt của axit sunfuric, axit photphoric… để tạo ra anken và ete trong các điều kiện kèm theo khác nhau. Các sản phẩm tạo thành của phản ứng phụ thuộc vào điều kiện kèm theo phản ứng.
– Phản ứng tổng hợp Williamson:
Trong quá trình tổng hợp Williamson, một ankyl halogenua được tạo ra để phản ứng với natri alkoxide dẫn đến việc hình thành ete.
Ví dụ:
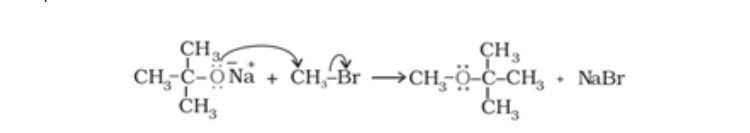
Phản ứng tổng hợp ete
– Phản ứng Alkyl Halide với Oxit bạc khô:
Khi alkyl halogenua được phản ứng oxit bạc khô, ete được tạo ra
2C2H5Br + Ag2O → C2H5-O-C2H5 + 2AgBr.
5. Ứng dụng quan trọng của ete
– Trong y khoa và dược lý:
+ Ete được sử dụng làm thuốc gây mê. Ví dụng như diethyl ether là một thành phần phổ quát trong gây mê được sử dụng trong phẫu thuật.
+ Ete được sử dụng làm thuốc giảm đau mạnh như methyl ete của morphine.

Diethyl ete ứng dụng làm thuốc gây mê
– Trong công nghiệp:
+ Làm dung môi cho chất béo, dầu, sáp, nước hoa, nhựa, thuốc nhuộm, gôm và hydrocacbon. Phenyl ete có thể được sử dụng làm môi trường tự nhiên truyền nhiệt vì nhiệt độ sôi cao.
+ Hơi của một số ete được sử dụng làm thuốc trừ sâu và thuốc xông đất.
+ Dimethyl ether được sử dụng làm chất làm lạnh và làm dung môi ở nhiệt độ thấp.
+ Ethyl ether là một dung môi tuyệt vời để chiết xuất cho nhiều loại phản ứng hóa học. Nó cũng được sử dụng làm nhiên liệu cho động cơ diesel và động cơ xăng trong thời tiết lạnh.
+ Methyl t-butyl ete (MTBE) là một chất phụ gia xăng giúp tăng chỉ số octan và giảm lượng chất gây ô nhiễm nitơ-oxit trong khí thải.
Trên đây là những thông tin cơ bản về ete. Nếu có bất luận thắc mắc nào bạn cũng có thể liên hệ với chúng tôi trong thanh chat phía cuối màn hình hiển thị hoặc tham khảo thêm những nội dung bài viết trên vietchem.com.vn.
