Trong hóa học, khi tìm hiểu về tính chất chất vật lý chắc hẳn tất cả chúng ta đều thấy xuất hiện yếu tố độ tan. Hãy cùng VIETCHEM đi tìm hiểu độ tan là gì, công thức tính độ tan và những yếu tố nào sẽ ảnh hưởng tác động đến độ tan của một chất, qua nội dung nội dung bài viết về sau nhé!
I. Độ tan là gì?
1. Khái niệm về độ tan
– Độ tan hay độ hòa tan là đại lượng đặc trưng cho khả năng hòa tan của một chất (rắn, lỏng hay khí) vào dung môi để tạo thành một dung dịch đồng nhất. Hay còn được hiểu đó đó là số gam của chất đó hòa tan vào trong 100g dung môi (thường là nước) để tạo ra một dung dịch bão hòa tại một xét tuyển nhiệt độ cho trước.

Độ tan là gì?
– Người ta thường dựa vào đặc trưng này để xác định chất đó là chất tan hay là không tan:
- Nếu 100g nước hòa tan được trên 10g chất thì nó sẽ là chất tan hay chất dễ tan
- Nếu 100g nước hòa tan được dưới 1g chất thì đó là chất ít tan
- Nếu 100g nước chỉ hòa tan được dưới 0,01g chất thì chúng được gọi là chất không tan
2. Tính tan của muối, axit, bazơ trong nước
– Hồ hết các axit đều tan trong nước, ngoại trừ axit silixic (H2SiO3)
– Phần lớn các bazơ không tan trong nước, trừ NaOH, Ba(OH)2, KOH,… và Ca(OH)2 ít tan
– Muối:
- Tất cả những muối Na, K, muối nitrat (-NO3) đều tan trong nước.
- Phần lớn các muối clorua và sunfat đều tan được.
- Phần lớn muối cacbonat sẽ không còn tan.
II. Công thức tính độ tan là gì?
– Độ tan được xác định theo công thức:
S = (mct/mdm) x 100
Trong số đó:
- S là ký hiệu của độ tan
- mct là khối lượng của chất tan
- mdm là khối lượng của dung môi
Ví dụ: Hãy xác định độ tan trong nước của muối Na2CO3 (khi ở 18 độ C). Biết rằng, khi ở nhiệt độ này, nếu hòa tan hết 53g Na2CO3 trong 250g nước thì sẽ thu được dung dịch bão hòa.
Độ tan của muối Na2CO3 là: SNa2CO3 = 53 x 100/ 250 = 21,2g.

Làm thế nào để tính được độ tan của một chất
– Từ công thức trên, tất cả chúng ta cũng luôn có thể suy ra được quan hệ giữa độ tan của một chất và nồng độ phần trăm dung dịch bão hòa của chúng ở một nhiệt độ xác định:
C% = 100 x S/ (100 + S)
Độ tan càng nhỏ tương ứng với chất càng ít tan và trái lại.
III. Các yếu tố ảnh hưởng tác động đến độ tan của một chất
1. Nhiệt độ
- So với chất khí, độ tan của nó trong dung môi tỷ lệ nghịch với nhiệt độ. Vì vậy, tất cả chúng ta có thể loại bỏ các chất khí như O2, CO2 thoát khỏi dung môi bằng phương pháp tiến hành đun nóng mà không làm chuyển đổi, phân hủy các chất, không những thế còn giữ được độ ổn định cho dược liệu.
- So với chất rắn thu nhiệt, nhiệt độ càng cao thì độ tan sẽ càng lớn. Còn khi đối chiếu với chất rắn tỏa nhiệt khi hòa tan thì nhiệt độ càng cao độ tan sẽ càng giảm.
2. Áp suất (khi đối chiếu với chất khí)
Theo định luật Henry, các chất khí với độ tan nhỏ và áp suất không thực sự cao thì lượng chất khí hòa tan trong một thể tích chất lỏng xác định sẽ tỷ lệ thuận với áp suất của nó trên một mặt bằng chất lỏng ở nhiệt độ không đổi. Vì vậy, nếu tăng áp suất, độ tan của chất khí sẽ tiến hành tăng lên và ngược lạ.
3. Độ phân cực của chất tan và dung môi
- Các chất phân cực dễ tan trong những dung môi phân cực như nước, kiềm, axit vô cơ, dung dịch muối,…
- Những chất ít phân cực dễ tan trong các dung môi hữu cơ kém phân cực như chloroform, toluene, benzene, dicloromethan,…
4. Dạng thù hình
Các chất rắn dạng vô định hình sẽ có được độ tan to ra thêm so với chất rắn dạng tinh thể. Nguyên nhân là vì ở dạng kết tinh có cấu trúc mạng lưới tinh thể tương đối vững bền. Do vậy, nó cần nhiều năng lượng để sở hữu thể phá vỡ cấu trúc hơn. Tuy nhiên, chất rắn dưới dạng vô định hình không ổn định như dạng tinh thể và thường có xu hướng chuyển sang dạng tinh thể.
5. Hiện tượng kỳ lạ hydrat hóa
Trong quá trình kết tinh, chất rắn có thể tồn tại dưới dạng khan hoặc ngậm nước. So với dạng ngậm nước, chất rắn ở dạng khan có độ tan to ra thêm.
6. Hiện tượng kỳ lạ đa hình
Tùy vào xét tuyển xẩy ra kết tinh mà một chất rắn có thể có những dạng tinh thể khác nhau như đồng kết tinh, hydrat,.. cùng với những tính chất vật lý và độ tan trong dung môi là rất khác nhau. So với những tinh thể kém bền sẽ cần ít năng lượng trong phá vỡ cấu trúc nên dễ tan hơn.
7. Độ pH của dung dịch
- Khi kiềm hóa dung môi, độ tan của axit yếu sẽ tăng lên
- Nếu axit hóa dung môi, các chất kiềm yếu sẽ có được độ tan tăng lên
- So với những chất lưỡng tính, độ pH càng gần điểm đẳng điện thì độ tan sẽ càng giảm và trái lại,
8. Chất điện ly
Chất điện ly trong dung dịch có khả năng làm giảm độ tan của đa số chất tan nên cần lưu ý pha loãng chất điện ly trước lúc hòa vào dung dịch.
9. Các ion cùng tên
Khi nồng độ của đa số ion cùng tên tăng lên, cân bằng điện ly của chất tan sẽ dần dần dịch chuyển về phía phân tử ít tan và làm giảm đi độ tan của chất. Vì vậy, để thực hiện việc hòa tan, cần tiến hành với những chất ít tan trước, sau đó mới là các chất dễ tan.
10. Hỗn hợp dung môi
Khi phối hợp các hỗn hợp dung môi đồng tan cùng với nước như glycerin-ethanol-nước thì độ tan của những chất khó tan sẽ tăng lên.
IV. Bảng tính tan hóa học của một số chất
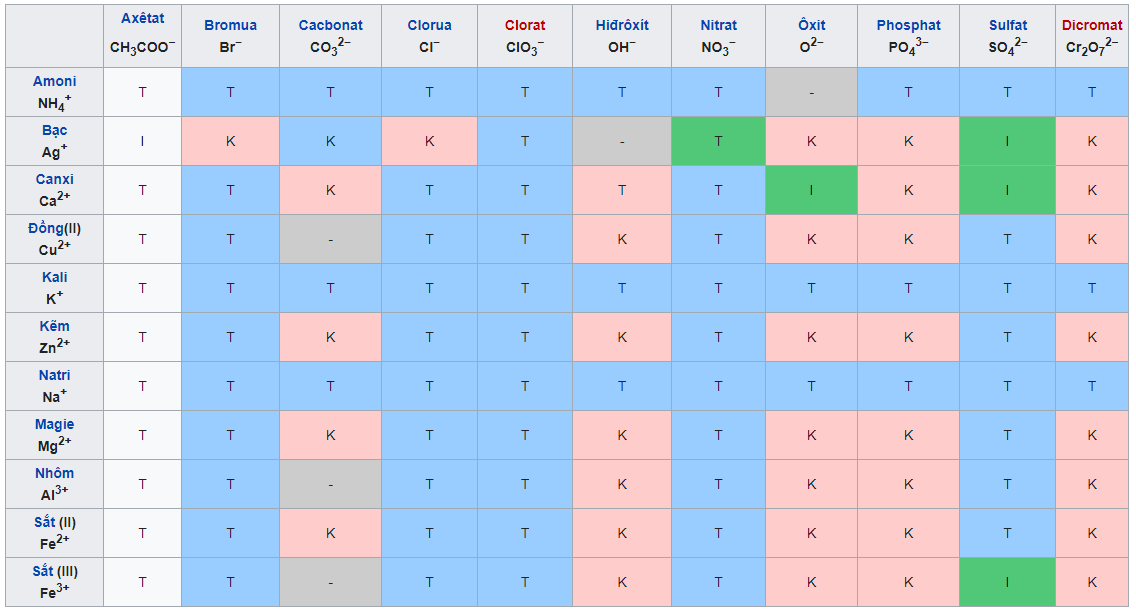
Bảng tính tan của muối, axit, bazơ
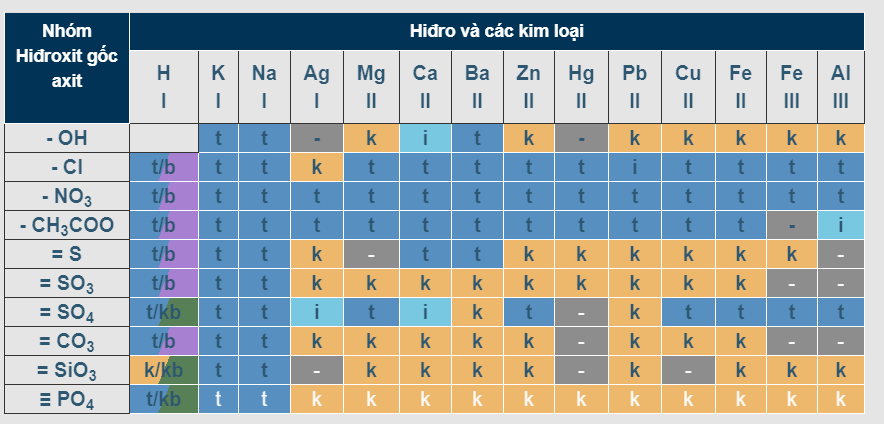
Bảng tính tan của hiđro cùng các kim loại
Trong số đó:
- T: chất dễ tan
- I: Chất ít tan
- K: Chất không tan
- B: Chất bay hơi
- (-): chất không tồn tại hoặc sẽ bị nước phân hủy
V. Hướng dẫn cách đọc bảng tính tan đơn giản nhất
– Bảng tính tan gồm có những hàng là các anion gốc axit (OH-) và các cột là các cation kim loại. Với tùy từng chất cụ thể, tất cả chúng ta sẽ xác định ra ion dương và âm, sau đó dóng theo hàng và cột tương ứng để biết được trạng thái của chất đó tại một ô.
– Có thể tham khảo cách học bảng tính tan thông qua bài thơ như:

Cách nhớ bảng tính tan bằng thơ
Cách ghi nhớ bảng tính tan:
Hợp chất
Tính chất
Trừ
Axit (xem ở cột ion H+ cùng anion gốc axit tường ứng)
Tan
H2SiO3
Bazơ (xa ở hàng in OH- cùng các cation tương ứng)
Không tan
NaOH, KOH, LiOH, Ca(OH)2, NH4OH, Ba(OH)2
– Muối liti
– Muối natri
– Muối Kali
– Muối amoni
Tan
– Muối bạc
Không tan (AgCl)
AgNO3, CH3COOAg
– Muối nitrat
– Muối axetat
Tan
– Muối clorua
– Muối bromua
– Muối iotua
Tan
– AgCl: kết tủa trắng
– AgBr: kết tủa vàng nhạt
– Agl: kết tủa vàng
– PbCl2, PbBr2, Pbl2
– Muối sunfat
Tan
– BaSO4, PbSO4, CaSO4: kết tủa trắng
– Ag2SO4: ít tan
– Muối sunfit
– Muối cacbonat
Không tan
Muối của kim loại kiềm cùng amoni NH4+
– Muối sunfua
Không tan
Muối của kim loại kiềm, kiềm thổ cùng amoni NH4+
– Muối photphat
Không tan
Muối, Na+, K+ và amoni NH4+
Trên đây là những thông tin cơ bản về độ tan là gì, công thức tính cũng như cách ghi nhớ tính tan đơn giản nhất, hy vọng với nội dung bài viết này độc giả đã có thêm vào cho mình những tài liệu tham khảo có lợi. Liên hệ với VietChem thông qua số hotline 0826 010 010 nếu có bất kỳ thắc mắc nào liên quan nhé.
