Khí H2S được chú ý gây độc khi xúc tiếp. Vậy nó là chất khí gì? Điểm sáng lý hóa ra sao để phân biệt? Mọi người hãy cùng nhau tìm hiểu trải qua nội dung bài viết sau đây nhé!
1. Khí H2S là gì? Cấu trúc khí H2S?
Khí H2S (được gọi là hydro sulfide) là một trong những hợp chất hóa học có những đặc trưng, rất dễ phân biệt.
H2S có cấu trúc tương tự như phân tử nước, H2S là việc phối kết hợp của 2 nguyên tử H và một nguyên từ S. Trong số đó, S là hạt trung tâm và chứa 2 hydro đơn độc được liên kết với một liên kết đơn.
Tuy nhiên, lưu huỳnh không hề có độ âm điện lớn như oxy nên H2S không phân cực như nước. Do đó, trong H2S tồn tại những lực liên phân tử tương đối yếu và điểm sôi cũng như điểm trung tâm chảy thấp hơn nhiều so với trong nước.
H2S được hình thành phổ cập nhất do sự phân hủy chất hữu cơ của vi sinh vật trong xét tuyển không hề có oxy (quy trình phân hủy kỵ khí). Khí hydro sulfide cũng rất được tìm thấy trong khí núi lửa, dầu thô, khí tự nhiên và một số trong những nguồn nước giếng hoặc suối nước nóng. Có một điều thú vị là khung hình con người cũng tiết ra một lượng nhỏ H2S được sử dụng tiếp như một phân tử truyền tín hiệu.

Cấu trúc của khí H2S
2. Tính chất lý hóa của khí H2S
Khí H2S có những tính chất sau đây:
2.1. Tính chất vật lý
Những tính chất vật lý đặc trưng cho khí H2S như sau:
- Có mùi rất đặc trưng là mùi trứng thối.
- Là một chất khí dễ cháy.
- Điểm sôi của nước và hiđro sunfua theo lần lượt là 100 độ C và – 60 độ C.
- Là chất khí đặc và nặng hơn không khí một ít nhưng khá hòa tan trong nước, dung môi hữu cơ.
- Đó là một loại khí độc, không màu, rất có thể kéo theo đau đầu trong cả khi hít phải một lượng nhỏ.
- Ở áp suất trên 90 GPa, H2S trở thành chất dẫn điện kim loại.
2.2. Tính chất hóa học
– Tính acid yếu:
- Có tính axit nên làm giấy quỳ tím chuyển sang red color.
- H2S có tài năng phản ứng với dung dịch kiềm tạo muối trung hòa và nước.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + H2O
- H2S có phản ứng với dung dịch muối cacbonat tạo muối trung hòa và nước.
H2S + Na2CO3 → NaHCO3 + NaHS
– Tính khử mạnh: H2S đóng vai trò là chất khử và thiết yếu là lúc xuất hiện của bazơ tiết ra SH-
- Hỗn hợp không khí và H2S rất có thể gây nổ theo phản ứng sau đây:
2H2S+ 3O2 → 2H2O + 2SO2
- H2S phản ứng với kim loại tạo muối sunfua kim loại không hòa tan và thường là chất rắn làm nên màu sẫm:
2H2S + 2K → 2KHS + H2
- H2S phản ứng với Ag tạo muối sulfite:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
- H2S bị oxy hóa khi phản ưngs với Clo tạo thành H2SO4 khi có nước:
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
3. Điều chế khí H2S ra sao?
Tùy vào xét tuyển mà rất có thể điều chế khí H2S bằng nhiều cách thức không giống nhau như sau:
3.1. Trong phòng thí nghiệm
H2S được tiết ra bằng phản ứng sắt sunfua bằng axit mạnh trong bình Kipp:
FeS + 2 HCl → FeCl2 + H2S
Hoặc những cách khác ví như:
– Sunfua kim loại và phi kim xúc tiếp với nước: 6 H2O + Al2S3 → 3 HS + 2Al(OH)3.
– Phân tích Thioacetamide: CH3C(S)NH2 + H2O → CH2C(O)NH2 + H2S.

3.2. Trong công nghiệp
Phương pháp phổ cập nhất để sinh sản hydro sunfua là tách nó thoát khỏi “khí chua” – một loại khí tự nhiên có hàm lượng H2S cao.
Ngoài ra, nó còn được điều chế bằng những cách khác ví như:
- Dùng S nhân tố nóng chảy tác dụng với H2 ở khoảng chừng 450 độ C.
- Vi trùng khử sunfat oxy hóa những hợp chất hữu cơ hoặc H2 trong xét tuyển oxy thấp.
4. Khí H2S có độc không?
Khí H2S là một loại khí độc bởi nhiều nguyên nhân sau đây:
- Nó là một loại khí rất dễ nổ, nó có tài năng gây ra những tình trạng rình rập đe dọa tính mệnh nếu xử lý không cẩn trọng. Ngoài ra, nó dễ cháy tạo thành những khí và hơi gây ô nhiễm khác ví như SO2.
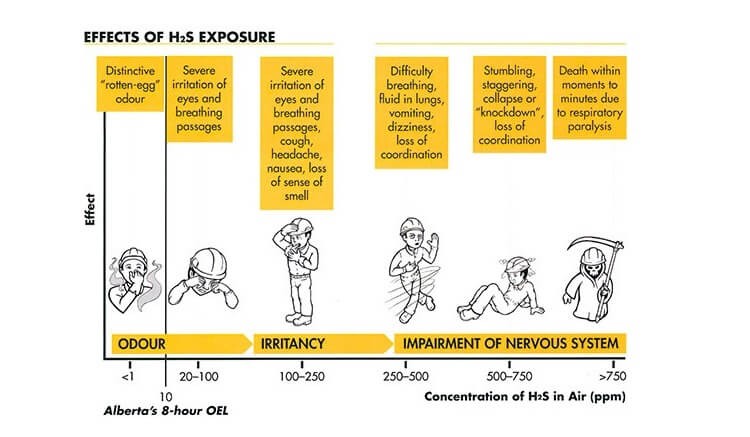
- Nếu mọi người xúc tiếp với nồng độ H2S thấp thì nó rất có thể gây ra một số trong những triệu chứng như: kích ứng cho mũi, cổ họng, mắt, buồn nôn, không thở được, đau đầu, giảm trí tưởng, mỏi mệt và những vấn đề về cân bằng khung hình. Một vài người rất có thể cảm thấy không thở được, nhất là những người dân mắc những bệnh như hen suyễn.
- Nếu xúc tiếp ngắn ngày với nồng độ H2S cao (thường to hơn 1000 ppm) rất có thể gây ngất, nhiều người kéo theo tổn thương vĩnh viễn hoặc lâu dài như đau đầu, giảm nguy cơ triệu tập, chóng mặt, trí tưởng kém và tác dụng vận động.
5. Ứng dụng của khí H2S trong đời sống
H2S được ứng dụng trong nhiều ngành không giống nhau như sau:
- Trong phân tích trong hóa học phân tích dùng để làm phát hiện những cation.
- H2S là tiền thân của lưu huỳnh nhân tố. Vì vậy, được ứng dụng S nhân tố, H2SO4 và một số trong những hợp chất lưu huỳnh hữu cơ như methanethiol, ethanethiol và axit thioglycolic…
- Để điều chế sunfua kim loại, nhiều loại trong số này được ứng dụng trong ngành sơn.
- Để tách deuterium oxide hoặc nước nặng khỏi nước thông thường trải qua quy trình Girdler sulfide.
- Trong nông nghiệp, H2S được sử dụng làm chất khử trùng.
- Trong nghành y tế, cho tế bào xúc tiếp với một lượng nhỏ khí H2S giúp ngăn ngừa tổn thương ty thể.
- Trong gia công kim loại, gia công: H2S là thành phần trong một số trong những loại dầu cắt và chất làm mát, chất bôi trơn.
Trên đấy là những thông tin cơ phiên bản về khí H2S. Nếu có bất kể thắc mắc nào chúng ta có thể liên hệ với công ty chúng tôi trong thanh chat phía cuối screen hoặc xem thêm thêm những nội dung bài viết trên vietchem.com.vn.
